Уравнение реакции и вывод глицерин. Химическая формула глицерина. Структурная и молекулярная формула. С активными металлами
При проведении опыта используемМикролабораторию для химического эксперимента
Цель опыта: изучить качественную реакцию на глицерин.
Оборудование: пробирки (2 шт.).
Реактивы: раствор гидроксида натрия NaOH, раствор сульфата меди(II) CuSO4, глицерин C3H5(OH)3.
1. В две пробирки вносим по 20-25 капель сульфата меди(II).
2. Добавляем к нему избыток гидроксида натрия.

3. Образуется осадок гидроксида меди(II) голубого цвета.

4. В одну пробирку по каплям добавляем глицерин.

5. Встряхиваем пробирку до исчезновения осадка и образования темно-синего раствора глицерата меди(II).

6. Сравниваем окраску раствора с окраской гидроксида меди(II) в контрольной пробирке.

Вывод:
Качественной реакцией на глицерин является его взаимодействие с гидроксидом меди (II).
Спирт, мало похожий на спирт.
Нитроглицерин получают, нитруя, обрабатывая смесью концентрированных кислот (азотной и серной, последняя нужна для связывания образующейся воды) простейшего и самого известного из трехатомных спиртов - глицерина С3Н5 (ОН) 3. Производство взрывчатых веществ и порохов - один из основных потребителей глицерина, хотя, конечно, далеко не единственный.
В наши дни довольно много глицерина идет на производство полимерных материалов. Глифталевые смолы - продукты реакции глицерина с фталевой кислотой, будучи растворены в спирте, превращаются в хороший, хотя и несколько хрупкий, электроизоляционный лак. Нужен глицерин и для производства намного более популярных эпоксидных смол. Из глицерина получают эпихлоргидрин - вещество, незаменимое при синтезе знаменитой «эпоксидки». Но не из-за этих смол и тем более не из-за нитроглицерина глицерин считается жизненно важным для нас веществом.
Его продают в аптеках. Но в медицинской практике чистый глицерин используют весьма ограниченно. Он хорошо смягчает кожу. В этом качестве - мягчителя кожи - мы в основном его и используем дома, в быту. В той же роли выступает он и на предприятиях обувной и кожевенной промышленности. Иногда вводят глицерин в состав медицинских свечей (при соответствующей дозировке он действует как слабительное). Этим, собственно, и ограничиваются лекарственные функции глицерина. Значительно шире применяют в медицинской практике производные глицерина, в первую очередь нитроглицерин и глицерофосфаты.
Глицерофосфат , который продают в аптеке, содержит в действительности два глицерофосфата. В состав этого лекарства, которое взрослым назначают при общем переутомлении и истощении нервной системы, а детям при рахите, входят 10% глицерофосфата кальция, 2% глицерофосфата натрия и 88% обыкновенного сахара.
Из глицерина синтетическим путем получают незаменимую аминокислоту метионин. В медицинской практике метионин используют при заболеваниях печени и атеросклерозе.
Производные глицерина всегда есть в организмах высших животных и человека. Это жиры - сложные эфиры глицерина и органических кислот (пальмитиновой, стеариновой и олеиновой)- самые энергоемкие (хотя и не всегда полезные) вещества организма. Подсчитано, что энергетическая ценность жиров в два с лишним раза больше, чем углеводов. Не случайно организм откладывает про запас именно это, самое калорийное «горючее». А кроме того, жировая прослойка служит и теплоизоляцией: теплопроводность жиров крайне низка. У растений жиры заключены главным образом в семенах. В этом - одно из проявлений извечной мудрости природы: тем самым она позаботилась об энергообеспечении следующих поколений…

Впервые на нашей планете глицерин был получен в 1779 г. Карл Вильгельм Шееле (1742-1786) кипятил оливковое масло со свинцовым глетом (окисью свинца) и получил сладковатую сиропообразную жидкость. Он назвал ее сладким маслом или сладким началом жиров. Определить точно состав и строение этого «начала» Шееле, конечно, не мог: органическая химия только— только начинала развиваться. Состав глицерина выяснил в 1823 г. французский химик Мишель Эжен Шеврель, занимавшийся исследованием жиров животного происхождения. А тот факт, что глицерин представляет собой трехатомный спирт, первым установил известнейший французский химик Шарль Адольф Вюрц. Он же, кстати, первым синтезировал в 1857 г. простейший двухатомный спирт этиленгликоль.
Синтетический глицерин из нефти (точнее, из пропилена) впервые получен в 1938 г.
Глицерин отчасти сходен с самым, пожалуй, популярным из спиртов - винным, или этиловым. Как и винный спирт : он горит голубым неярким пламенем. Как и винный спирт, он активно поглощает влагу из воздуха. Как и при образовании спиртоводных растворов, при смешении глицерина и воды суммарный объем оказывается меньше, чем объем исходных компонентов. Как и этиловый спирт, глицерин нужен для производства порохов. Но если в этом производстве роль C2H5OH, в общем-то, подсобная, то глицерин - незаменимое сырье для получения нитроглицерина. А значит, и баллиститного пороха, и динамита тоже. Наконец, как и винный спирт, глицерин входит в состав алкогольных напитков.
Правда, вопреки распространенному мнению, в составе ликеров глицерина нет. Ликеры загущают сахарным сиропом. А вот в натуральных винах глицерин присутствует обязательно. Подобные вина подают в дорогих заведениях, подобных http://www.tatarcha.net/ и кто бы мог подумать, что когда-то из них хотели получать столь дешевый ныне глицерин.
Глицерин образуется при гидролизе жиров, когда при высоком давлении (25 105 паскалей) и температуре немного выше 200 °С вода разрушает жиры. Но лишь немногим известно, что тот же самый глицерин - нормальный продукт сбраживания сахаров. Около трех процентов сахара, содержащегося в винограде, в конечном счете превращается в глицерин. В вине, правда, глицерина намного меньше: в процессе созревания вина он частично превращается в другие органические вещества, но доли процента глицерина есть во всех натуральных винах, а в некоторые вина его вводили и вводят преднамеренно, например при приготовлении хорошего портвейна по классической технологии.
В конце прошлого века, когда спрос на глицерин вырос во всех промышленно развитых странах, химики вполне серьезно обсуждали возможности извлечения глицерина из отходов винокурен, конкретно - из барды. В наши дни потребность в глицерине еще больше: но из барды его все-таки не извлекают. Сейчас глицерин получают в основном синтетическим путем - из пропилена, хотя не утратил значения и классический способ производства глицерина - гидролизом жиров.
Если чистый глицерин охлаждать очень медленно, он затвердевает при температуре около 18 °С. Но эту своеобразную жидкость куда проще переохладить, чем превратить в кристаллы. Он может оставаться жидким и при температуре ниже 0°С. Подобным же образом ведут себя его водные растворы. Например, раствор, в котором на две весовых части глицерина приходится одна часть воды, замерзает при минус 46,5 °С.
К тому же, глицерин - жидкость умеренно вязкая, почти не токсичная, хорошо растворяющая многие органические и неорганические вещества. Из-за этого комплекса свойств глицерин недавно нашел весьма неожиданное применение.
Здесь позволим себе небольшое лирическое отступление.
У Маяковского в заключительной части поэмы «Про это» есть такие строки:
Вот он,
большелобый
тихий химик,
перед опытом наморщил лоб.
Книга - «Вся земля» -
выискивает имя.
Век двадцатый.
Воскресить кого б?
Прервем цитату, обратимся к печальной прозе.
В 1967 г. умер от лейкоза известный американский психолог профессор Джеймс Бедфорд. Согласно воле покойного, сразу же по наступлении клинической смерти его тело было заморожено
. Бедфорд надеялся, что сверхнизкие температуры остановят процесс распада клеток и сохранят их неизменными до тех пор, пока наука найдет средства борьбы с пока еще неизлечимой болезнью. Тогда тело разморозят и попытаются вернуть ученого к жизни…
Вряд ли эти надежды можно считать обоснованными. Крупнейший специалист в области реанимации академик АМН В. А. Неговский писал, что, охладив тело до температуры ниже + 10 °С, можно продлить еще обратимое состояние клинической смерти до 40-60 минут. Использование же минусовых температур при замораживании живых тканей и клеток приводит к их гибели.
Тем не менее надежды на воскрешение в будущем привлекают многих. Эти надежды питает вера во всемогущество науки будущего. В какой-то степени эту веру подкрепляют некоторые свойства глицерина и приготовленных на его основе кровезаменителей.
Качественная реакция на глицерин
В США процедуре замораживания в надежде на оживление и излечение в будущем подверглось более тысячи человек. В городке Фармингдейл в 1971 г. начала функционировать «клиника для мертвецов». Сразу же после смерти из тела пациента этой клиники выпускают всю кровь и заполняют вены специальным глицериновым раствором. После этого тело обертывают в станиоль и помещают в сосуд с сухим льдом (- 79 °С), а затем в специальную герметичную капсулу с жидким азотом. «Если своевременно менять азот, тело никогда не разложится»,- заявил руководитель клиники К. Гендерсон.

Но ведь этого же мало! Не затем соглашались люди на посмертное замораживание, чтобы хорошо сохранились их трупы.
Глицерин действительно затрудняет образование кристаллов льда, разрушающих кровеносные сосуды и клетки. Однажды уже удалось оживить сердце эмбриона цыпленка, охлажденного в глицерине почти до абсолютного нуля. Но сделать что-либо подобное с целым организмом пока еще даже не пытались. Вывести человека из состояния клинической смерти спустя годы после ее наступления - тоже. Поэтому еще раз процитируем Владимира Александровича Неговского:
«Я знаю, - говорил он, - лишь один подобный случай со счастливым концом - это случай со спящей красавицей. От столетнего сна ее пробудил поцелуй. Это тоже способ реанимации, да к тому же еще и приятный».
Но глицерин - добавим от себя - здесь не при чем.
Трехатомные спирты (глицерин).
Трехатомиые спирты содержат три гидроксильные группы при разных углеродных атомах.
Общая формула СnН2n — 1(ОН)3.
Первый и основной представитель трехатомных спиртов - глицерин (пропантриол-1,2,3) HОСН2-СHOH-СН2ОН.
Номенклатура. Для названия трехатомных спиртов по систематической номенклатуре необходимо добавить к названию соответствующего алкана суффикс -триол.
Изомерия трехатомных спиртов, как и двухатомных, определяется строением углеродной цепи и положением в ней трех гидроксильных групп.
Получение. 1. Глицерин можно получать гидролизом (омылением) растительных или животных жиров (в присутствии щелочей или кислот):
H2C-O-C//-C17H35 H2C-OH
HC-O-C//-C17H35 + 3H2O ® HC-OH + 3C17H35COOH
H2C-O-C//-C17H35 H2C-OH
триглицерид (жир) глицерин стеариновая
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот - мыла (поэтому этот процесс называется омылением).
2. Синтез из пропилена (промышленный способ):
| Cl2, 450-500 oC | H2O (гидролиз)
CH ----® CH ----®
пропилен хлористый
CH2OH HOCl (гипо- CH2OH CH2OH
| хлорирование) | H2O (гидролиз) |
®CH ----® CHOH ----® CHOH
|| -HCl | -HCl |
аллиловый монохлор- глицерин
спирт гидрин
глицерина
Химические свойства. По химическим свойствам глицерин во многом напоминает этиленгликоль. Он может реагировать одной, двумя или тремя гидроксильными группами.
1. Образование глицератпов.
Глицерин, вступая в реакции со щелочными металлами, а также с гидроксидами тяжелых металлов, образует глицераты:
H2С-OH H2C-Oæ /O- CH2
2 HC-OH + Cu(OH)2 ® HC-O/ãO- CH + 2H2O
H2C-OH H2C-OH HO-CH2
глицерат меди
2. Образование сложных эфиров. С органическими и минеральными кислотами глицерин образует сложные эфиры:
H2C-OH HO-NO2 H2C-O-NO2
HC-OH + HO-NO2 -® HC-O-NO2 + 3H2O
H2C-OH HO-NO2 H2C-O-NO2
глицерин азотная тринитрат
кислота глицерина
(нитроглицерин)
H2C-OH HO-OC-CH3 H2C-O-COCH3
HC-OH + HO-OC-CH3 -® HC-O-COCH3 + 3H2O
H2C-OH HO-OC-CH3 H2C-O-COCH3
глицерин уксусная триацетат
кислота глицерина
3. Замена гидроксильных групп на галогены. При взаимодействии глицерина с галогеноводородами (НС1, НВr) образуются моно- и дихлор- или бромгидрины:
H2C-OH ® HC-OH ® HC-Cl ù CH2\
| HCl | | HCl | | | KOH | O
HC-OH --| H2C-OH -- | H2C-OH|---® CH/
| -H2O | -H2O | | -KCl, -H2O |
H2C-OH ® H2C-OH ® H2C-Cl û CH2Cl
монохлор- дихлор- эпихлор-
гидрины гидрины гидрин
4. Окисление. При окислении глицерина образуются различные продукты, состав которых зависит от природы окислителя. Начальными продуктами окисления являются: глицериновый альдегид HOCH2-CHOH-CHO, дигидроксиацетон НОСН2-СО-CН2ОН и конечный продукт (без разрыва углеродной цепи) - щавелевая кислота НООС-СООН.
Отдельные представители. Глицерин (пропантриол-1,2,3) НОСН2-СНОН-СН2OН — вязкая гигроскопическая нетоксичная жидкость (т. кип. 290 °С с разл.), сладкая на вкус. Смешивается с водой во всех соотношениях. Используют для производства взрывчатых веществ, антифризов и полиэфирных полимеров. Находит применение в пищевой (для изготовления кондитерских изделий, ликеров и т.д.), текстильной, кожевенной и химической промышленности, в парфюмерии.
Предыдущая891011121314151617181920212223Следующая
Главная / Глицерин
Глицерин
Стандарт качества
ГОСТ 6824-96
Формула
Описание
Вязкая жидкость без цвета и запаха, сладкая на вкус. Из-за своего сладкого привкуса вещество и получило своё название (лат.> glycos [гликос] — сладкий). Смешивается с водой в любых соотношениях. Не ядовит. Температура плавления глицерина - 8°С, температура кипения - 245°С. Плотность глицерина - 1.26 г/см3.
Химические свойства глицерина типичны для многоатомных спиртов. Из органических соединений хорошо растворяется в спирте, но не растворим в жирах, аренах, эфире и хлороформе. Сам глицерин хорошо растворяет моно- и дисахариды, а также неорганические соли и щелочи. Отсюда — широкий спектр применения глицерина. В 1938 был разработан метод синтеза глицерина из пропилена. Этим путем производят значительную часть глицерина.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника.
Глицерин используется как пищевая добавка Е422 в производстве кондитерских изделий для улучшения консистенции, для предотвращения проседания шоколада, увеличения объема хлеба.
Добавление глицерина уменьшает время зачерствения хлебных изделий, делает макароны менее клейкими, уменьшает налипание крахмала при выпечке.
Глицерин применяется при изготовлении экстрактов кофе, чая, имбиря и других растительных веществ, которые мелко измельчают и обрабатывают водным раствором глицерина, нагревают и испаряют воду. Получается экстракт, в котором содержится около 30% глицерина. Глицерин широко используется при производстве безалкогольных напитков. Экстракт, приготовленный на основе глицерина, в разбавленном состоянии придает напиткам «мягкость».
Из-за своей высокой гигроскопичности глицерин используют при заготовке табака (чтобы сохранить листья влажными и устранить неприятный вкус).
В медицине и в производстве фармацевтических препаратов глицерин используют для растворения лекарств, повышения вязкости жидких препаратов, предохранения от изменений при ферментации жидкостей, от высыхания мазей, паст и кремов. Используя глицерин вместо воды можно приготовить высококонцентрированные медицинские растворы. Так же он хорошо растворяет йод, бром, фенол, тимол, хлорид ртути и алкалоиды. Глицерин обладает антисептическими свойствами.
Глицерин усиливает моющую способность большинства сортов туалетного мыла, в которых он используется, придает коже белизну и смягчает её.
В сельском хозяйстве глицерин применяется для обработки семян, что способствует их хорошему прорастанию, деревьев и кустарников, что защищает кору от непогоды.
Глицерин в текстильной промышленности применяется в ткачестве, прядении, крашении, что придает тканям мягкость и эластичность. Его используют для получения анилиновых красок, растворителей для красок, при производстве синтетического шелка и шерсти.
В бумажной промышленности глицерин применяют в производстве папиросной бумаги, пергамента, кальки, бумажных салфеток и жаронепроницаемой бумаги.
В кожевенной промышленности используют глицериновые растворы в процессе жировки кож, добавляя его к водным растворам хлорида бария. Глицерин входит в состав восковых эмульсий для дубления кожи.
Глицерин широко применяется в производстве прозрачных упаковочных материалов.
КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ГЛИЦЕРИН
Благодаря своей пластичности, свойству удерживать влагу и стойко переносить холод, глицерин используется в качестве пластификатора при производстве целлофана. Глицерин является составной частью при получении пластмасс и смол. Полиглицерины используют для покрытия бумажных мешков, в которых хранится масло. Бумажный упаковочный материал становится огнестойким, если его под давлением пропитать водным раствором глицерина, буры, фосфата аммония, желатина.
В лакокрасочной промышленности глицерин является составляющим компонентом полировочных составов, особенно лаков, применяемых для окончательной отделки.
В радиотехнике глицерин широко используют в производстве электролитических конденсаторов, алкидных смол, которые применяются как изоляционный материал, при обработке алюминия и его сплавов.
Лечебные свойства и показания к применению глицерина
Глицерин в 10-30% смеси с водой, этиловым спиртом, ланолином, вазелином обладает способностью смягчать ткани и применяется обычно как смягчающее средство для кожи и слизистых оболочек.
Глицерин используется как основа для мазей и как растворитель для ряда лекарственных веществ (буры, танина, ихтиола и др.).
На основе глицерина готовятся и другие безжирные средства для ухода за кожей — кремы (кремы-глицероляты), желе (безжирные мази) и другие лекарственные формы и косметические препараты, например, 3-5% глицерина добавляется в лосьоны для смягчения кожи).
В смеси с нашатырным спиртом и спиртом (нашатырного спирта — 20,0, глицерина — 40,0, спирта этилового 70% — 40,0) глицерин применяется как средство для смягчения кожи рук (для обтирания рук при сухой коже).
Упаковка
От 1 и 2.5 литровых полиэтиленовых бутылок для исследовательских и лабораторных применений, 25 и 190 литровых пластиковых бочек, до1000 литровых контейнеров.
Транспортировка
Транспортируют в алюминиевых или стальных железнодорожных цистернах и бочках.
Хранение
Хранят глицерин в герметичных емкостях из алюминия или нержавеющей стали под азотной подушкой
в проветриваемом сухом помещении при невысокой температуре.
Срок годности глицерина — 5 лет со дня изготовления.
Технические характеристики
— Молярная масса - 92,1 г/моль
— Плотность - 1,261 г/см3
— Термические свойства
— Температура плавления - 18 °C
— Температура кипения - 290 °C
— Оптический показатель преломления - 1,4729
номер CAS - 56-81-5
— SMILES - OCC(O)CO
| Показатели | Глицерин | |||
| Ц-98 | ПК-94 | Т-94 | Т-88 | |
| Относительная плотность при 20 °С 1 по отношению к воде этой же температуры, не менее | 1,2584 | 1,2481 | 1,2481 | 1,2322 |
| Плотность при 20 °С, г/ см3, не менее | 1,255 | 1,244 | 1,244 | — |
| Реакция глицерина, 0,1 моль/ дм3 раствора НС1 или КОН, см3, не более | 1,5 | 1,5 | 1,5 | 1,5 |
| Массовая доля чистого глицерина, %, не менее | 98 | 94 | 94 | 88 |
| Массовая доля золы, %, не более | 0,14 | 0,01 | 0,02 | 0,25 |
| Коэффициент омыления (сложные эфиры), мг КОН на 1 г глицерина, не более | 0,7 | 0,7 | 2,0 | — |
| Хлориды | Следы | Отсутствие | Следы | — |
| Сернокислые соединения (сульфиты) | « | « | « | — |
| Углеводы, акролеин и другие восстанавливающие вещества, железо, мышьяк | Отсутствие | |||
| Содержание свинца, мг/ кг, не более | — | 5,0 | — | — |
Отгрузка от 1 кг! Доставка по РФ! Работаем только с Юридическими лицами (в т.ч. ИП) и только по безналичному расчёту!
Многоатомные спирты
– это органические
соединения, в молекулах которых содержатся две
или более гидроксильных групп, соединенных с
углеводородным радикалом.
Группы ОН в многоатомных спиртах размещаются у
разных атомов углерода:
Соединения с двумя группами ОН при одном атоме углерода неустойчивые. Они отщепляют воду и превращаются в альдегиды:
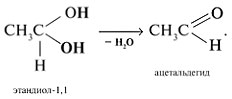
Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами).
Получение
Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха в присутствии серебряного катализатора алкены превращаются в двухатомные спирты:

Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
На производстве глицерин получают по схеме:

Физические свойства
Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий). Растворимость в воде – неограниченная. Температуры кипения этиленгликоля – 197,2 °С, глицерина – 290 °С. Этиленгликоль – яд.
Химические свойства
Этиленгликоль и глицерин подобны одноатомным
спиртам.
Так, они
реагируют с активными металлами
:

Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:

Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:

Качественная реакция многоатомных спиртов , позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH) 2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):

 |
УПРАЖНЕНИЯ.
1. Подчеркните структурные формулы многоатомных спиртов:
СlСН 2 СН 2 Сl, НОС 3 Н 7 , НОСН 2 СН 2 ОН,
С 2 Н 6 О 2 , 
НОСН 2 СООН, НОСН 2 СН 2 СН 2 ОН, СН 3 ОСН 2 СН 2 ОН.
2. По названиям веществ составьте их структурные формулы:
а) этандиол-1,2; б) этиленгликоль; в) пропандиол-1,2,
г) пропандиол-1,3;
д) глицерин; е) бутантриол-1,2,4.
3.
Составьте уравнения реакций
получения этиленгликоля из:
а) этилена; б) 1,2-дибромэтана.
4. Укажите пять областей применения многоатомных спиртов (этиленгликоля и глицерина).
5. Напишите уравнения реакций для цепочки химических превращений, назовите органические вещества:
6.
Составьте цепочку химических
превращений получения двухатомного спирта
СН 3 СНОНСН 2 ОН из алкана
С 3 Н 8 .
Используйте схему:
предельный углеводород
моногалогенуглеводород
непредельный углеводород дигалогенуглеводород двухатомный спирт.
Ответы на упражнения к теме 2
Урок 20
1. Подчеркнуты структурные формулы многоатомных спиртов:
2. Структурные формулы, составленные по названиям веществ:
3. Реакции получения этиленгликоля:

4. Пять областей применения многоатомных спиртов.
Этиленгликоль
(ЭГ) – в антифризах, 66%-й ЭГ
замерзает при –60 °C;
в синтезе лавсана [–СН 2 СН 2 О(О)СС(О)O–]n
;
растворитель (t
кип = 198 °С).
Глицерин
– в парфюмерии, косметике,
медицине – растворитель, компонент мазей;
для производства тринитроглицерина –
взрывчатого вещества и лекарства, расширяющего
сосуды.
5. Реакции для цепочки химических превращений:

6. Цепочка химических превращений алкана С 3 Н 8 в пропиленгликоль СН 3 СНОНСН 2 ОН через промежуточные вещества заданных классов.
представляет собой бесцветную, вязкую жидкость, простейший трехатомный спирт. Нетоксичная, без запаха, сладкая на вкус, отчего и получила свое название (гликос - сладкий). Растворяется во всех пропорциях в воде и спирте, почти не растворяется в эфире, сероуглероде, хлороформе, жирных и эфирных маслах и бензине, сильно гигроскопичен.Глицерин легко реагирует со многими органическими и неорганическими соединениями, образуя сложные эфиры, алифатические и ароматические простые эфиры и глицериды (глицераты) металлов.
Плотность 1,261 г/см³. Температура плавления - 18° C, температура кипения - 290° C.
Химическая формула: C 3 H 5 (OH) 3
Глицерин получают как побочный продукт при производстве мыла. Большинство синтетических методов получения глицерина основано на использовании пропилена в качестве исходного продукта.
Промышленностью выпускаются следующие виды глицерина: натуральный сырой 1-го, 2-го и 3-го сортов (ГОСТ 6823-2000) и дистиллированный высшего сорта, 1-го и 2-го сортов (ГОСТ 6824-96).
 Применение глицерина (1, 2, 3-тригидроксипропана, 1, 2, 3-пропантриола).
Применение глицерина (1, 2, 3-тригидроксипропана, 1, 2, 3-пропантриола).
Военное дело.
Глицерин используют для получения нитроглицерина, из которого производят динамит, бездымный порох и другие взрывчатые вещества, применяемые в мирных целях и военном деле, используют в качестве незамерзающих растворов в различных двигателях, тормозной и нагревающей жидкости, для охлаждения стволов орудий.
Табачная промышленность.
Благодаря высокой гигроскопичности глицерин используют для регулирования влажности табака с целью устранения неприятного раздражающего вкуса.
Производство пластических масс.
Глицерин является ценной составной частью при получении пластмасс и смол. Эфиры глицерина широко применяют в производстве прозрачных упаковочных материалов. Например, целлофан обладает отличной гибкостью и не теряет своих свойств ни в жаре, ни в холоде.
Пищевая промышленность.
Глицерин (пищевая добавка Е422) используют для приготовления экстрактов чая, кофе, имбиря и других растительных веществ, которые измельчают, увлажняют и обрабатывают глицерином, нагревают и извлекают водой для получения экстракта, содержащего около 30 % глицерина. Глицерин широко применяют при производстве безалкогольных напитков. Глицерин используют при получении горчицы, желе и уксуса.
Сельское хозяйство.
Глицерин используют при обработке семян и сеянцев. Разбавленные растворы глицерина помогают прорастанию овса и других злаков.
Медицинская промышленность.
Глицерин находит широкое применение в медицине и производстве фармацевтических препаратов. Глицерин обладает антисептическими свойствами, поэтому его применяют для предотвращения заражения ран.
Электротехника и радиотехника.
В радиотехнике глицерин широко используют в производстве электролитических конденсаторов. Глицерин используют при производстве алкидных смол, которые применяют как изоляционный материал.
Текстильная, бумажная и кожевенная отрасли промышленности.
Глицерин в текстильной промышленности применяют в прядении, ткачестве, печатании, крашении и шлихтовании. Глицерин придает тканям эластичность и мягкость. Его используют для получения анилиновых красок, растворителей для красок, а также в качестве антисептической и гигроскопической добавки к краскам для печатания. Глицерин широко используют при производстве синтетического шелка и шерсти.
В бумажной промышленности глицерин применяют при выпуске кальки, пергамента, папиросной бумаги, бумажных салфеток и жиронепроницаемой бумаги.
В кожевенной промышленности глицерин добавляют к водным растворам хлорида бария, который используют в качестве препарата для консервирования кож. Глицерин является одним из компонентов восковых эмульсий для дубления кож.
Лакокрасочная промышленность.
Глицерин - ценный компонент полировочных составов, особенно лаков, применяемых для окончательной отделки.
Производство моющих и косметических средств.
Большое количество сортов туалетного мыла содержит глицерин, который усиливает его моющую способность, придает белизну коже и смягчает ее. Глицериновое мыло способствует удалению красящих веществ кожи, загоревшей на солнце. В косметике полиолы используются в качестве увлажнителей. Глицерин - натуральный продукт, получаемый при гидролизе растительных масел. Обладая гигроскопичными свойствами, он увлажняет кожу, придавая ей мягкость и эластичность.
Другие области применения.
Для изготовления замазок, гектографической массы, копировальных чернил, штемпельных красок, в кожевенном деле и для других целей.
| Наименование показателя | Норма для сортов | |||
| первого | второго | третьего | ||
| марки 1 | марки 2 | |||
| Массовая доля чистого глицерина, %, не менее | 86 | 86 | 82 | 78 |
| Реакция глицерина, см³ 0,1 моль/дм³ (0,1 н.) раствора HCl или КОН, не более | 6,0 | 6,0 | 6,0 | 6,0 |
| Массовая доля золы, %, не более | 0,35 | 1,80 | 3,00 | 9,50 |
| Массовая доля нелетучего органического остатка, не более | 0,85 | 2,0 | 3,0 | 4,0 |
| Жирные кислоты и смолы (качественная реакция) | Отсутствие | Следы | ||
| Сернокислые соединения (сульфаты) (качественная реакция) | То же | То же | ||
| Реакция на поверхностно-активные вещества (ПАВ) в глицерине, см³ 0,1 моль/дм³ (0,1 н.) раствора HCl, не более | 2,0 | 5,0 | 6,0 | Не нормируются |
| Белковые вещества в глицерине, поступающем на дистилляцию (качественная реакция) | Отсутствие | То же | ||
Требования безопасности.
Сырой глицерин - горючий, нетоксичный продукт.
Глицерин термически неустойчив, при длительном нагреве (даже до 90-130° C) разлагается с образованием легковоспламеняющихся веществ (акролеина, ацетона), понижающих температуру вспышки до 112° C.
Не допускается применять открытый огонь в местах хранения сырого глицерина и проведения работ с ним.
Производственные помещения, в которых проводят работы с сырым глицерином, должны быть оборудованы приточно-вытяжной вентиляцией.
Добрый день, друзья! Сегодня мы поговорим об удивительном веществе — глицерине.
Глицерин – довольно распространенное вещество. Его можно встретить в составе многих лекарственных средств, мазей, кремов, мыла и даже в шампунях .
Как получают и где применяют
Основную часть глицерина получают в качестве побочного продукта при омылении жиров.
Область применения глицерина обширна. Он используется во многих производствах: медицинской, табачной, текстильной, бумажной, лакокрасочной промышленности, при производстве бытовой химии, электроники, радиотехники и т.д.
Глицерин свойства которого настолько разнообразны, широко применяется и в домашних условиях. Например, при лечении кожных болезней и ожогов, эффективен при кашле, обладает слабительным свойством, является самым простым увлажняющим средством.
Самые распространенные рецепты применения глицерина в домашних условиях:
Глицерин физико химические свойства этого удивительного вещества, рассмотрим более подробно.
Химические свойства
Химические свойства глицерина такие же, как и у других многоатомных спиртов. И это далеко не все свойства глицерина. Одним из плюсов применения глицерина является невысокая цена и доступность, поэтому его уникальные свойства можно с легкостью использовать в . Глицерин можно приобрести в аптеках или интернет-магазинах.
Давайте рассмотрим основные свойства глицерина, которые будут полезны при применении .
Физические свойства
 Медицинский глицерин – бесцветная вязкая жидкость, без запаха, сладкая на вкус. Именно поэтому и получил свое название («гликос» по-гречески - сладкий). Глицерин неядовит, растворяется в воде в любых количествах, является неплохим растворителем для неорганических солей, щелочи, моно- и дисахаридов.
Медицинский глицерин – бесцветная вязкая жидкость, без запаха, сладкая на вкус. Именно поэтому и получил свое название («гликос» по-гречески - сладкий). Глицерин неядовит, растворяется в воде в любых количествах, является неплохим растворителем для неорганических солей, щелочи, моно- и дисахаридов.
Гигроскопичность – способность веществ поглощать влагу из воздуха
Глицерин в чистом виде гигроскопичен, то есть способен отнимать влагу (вбирает в себя воду до 40 % от своего веса), поэтому может высушивать кожу. Но в том количестве (процентном соотношении обычно не превышает 7%), в котором он применяется в косметологии, оказывает обратное (увлажняющее) действие. Глицерин нашел широкое применение в качестве увлажняющего и смягчающего средства.
После использования косметического средства с добавлением глицерина ваша кожа получит увлажнение, смягчится, станет гладкой и эластичной. В чистом же виде, наоборот, высушит кожу, поэтому отдельно в косметологии не используется.

Глицерин вытягивает влагу из окружающего воздуха и насыщает ею нашу кожу, образуя на поверхности кожи влажную пленку. А если воздух вокруг сухой? В этом случае глицерин будет забирать влагу из слоев кожи, подсушивая ее.
Именно поэтому необходимо придерживаться некоторых правил при использовании глицерина в косметике :
не использовать глицерин в чистом виде и не пользоваться средствами с глицерином в условиях сухого климата.
Растворимость
Глицерин способен растворять различные органические и неорганические вещества: йод, щелочи, различные соли, сахара и т.д. Он усиливает моющую способность чистящих средств. Является частым гостем в составе средств для очистки стекол, поможет удалить жирные пятна.
Пластичность
Глицерин усиливает моющую составляющую мыла и придает ему пластичности. Благодаря этому работать с мыльной основой с добавлением глицерина проще, и возможностей воплощения идей больше. Это же свойство глицерина используется для маскировки низкого качества. Плохая водка, если в нее добавить глицерин, не подмерзает на холоде, а становится немного тягучей, как качественный аналог. Поэтому если вы встретили в составе водки глицерин, делайте соответствующие выводы.

Антисептик
Глицерин – отличный антисептик. Вы, наверное, замечали, что при применении крема с добавлением глицерина ранки затягиваются быстрее.
Зачастую применяется сочетание сразу нескольких свойств глицерина. Например, глицерин используется в качестве смягчителя при производстве тканей и кожи, благодаря своей пластичности и гигроскопичности. В домашних условиях может помочь вернуть .
В косметических целях глицерин важен при изготовлении смягчающих, увлажняющих и очищающих масок, лосьонов, кремов. Как любой натуральный продукт, он лучше, чем синтетический продукт, принимается кожей.
Глицериновые маски полезны не  только при уходе за кожей лица и рук, но и сослужат отличную службу при
только при уходе за кожей лица и рук, но и сослужат отличную службу при
Цель опытов с глицерином - ознакомить учащихся с теми свойствами, которые обусловливают применение этого вещества в повседневной жизни, и показать, что глицерин является многоатомным спиртом (имеет как общие с одноатомными спиртами реакции, так и отличные от них).
^ Растворимость глицерина в воде . В демонстрационную пробирку (или небольшой цилиндр) наливают 5-7 мл глицерина и сверху по стенке прибавляют такой же объем подкрашенной (например, фуксином) воды. При встряхивании жидкость становится однородной и окрашивается равномерно.
^ Понижение точки замерзания водных растворов глицерина . Водные растворы глицерина (и этиленгликоля) применяются в качестве незамерзающих жидкостей для охлаждения моторов автомашин и самолетов.
а) Пробирку с полученным в предыдущем опыте водным раствором глицерина помещают в охладительную смесь (лед с поваренной солью). Одновременно в смесь помещают пробирку с водой. Через несколько минут убеждаются в том, что вода в пробирке замерзла, раствор же глицерина остался жидким.
Б) Ученики могут провести исследование и определить: при каком процентном содержании глицерина в воде раствор перестает замерзать на улице в зимнее время.
Для этого готовят растворы следующих концентраций: 5%, 10%, 15%, 20% и т.д. - выставляют их на улицу в «мягкий» зимний день и затем в морозный. Отмечают температуру воздуха и устанавливают, начиная с какой концентрации растворы глицерина при данной температуре не замерзают.
^ Гигроскопичность глицерина . Свойство глицерина поглощать влагу и тем самым увлажнять предметы используется, например, для смягчения кожи.
На лист фильтровальной бумаги наносят несколько капель глицерина. На другой лист наносят столько же капель воды. К концу урока убеждаются, что бумага с водой высохла, а бумага с глицерином стала еще более влажной.
^ Горение глицерина. Демонстрация этого опыта важна тем, что позволяет устранить встречающееся иногда у учащихся неверное представление, будто с увеличением числа атомов углерода в молекуле органического вещества непременно возрастает светимость пламени. Это заключение у них появляется из сопоставления горения метана и этилена. Глицерин содержит три атома углерода в молекуле и тем не менее горит почти бесцветным пламенем, так как он богат кислородом и в процентном отношении содержит углерода меньше, чем этилен.
В небольшой пробирке или в тигельке нагревают до кипения 1 мл глицерина и поджигают выделяющиеся пары. Они горят почти бесцветным пламенем. Может оказаться, что глицерин сразу не загорается из-за присутствия в нем воды; в таком случае он должен быть предварительно обезвожен интенсивным нагреванием.
^ Реакция глицерина с натрием . Опыт демонстрирует общность свойств глицерина со спиртами.
В пробирку с 1-2 мл глицерина бросают очищенный кусочек натрия величиной с горошину. Пробирку слегка подогревают. Реакция идет вначале медленно, затем все более энергично.
Поджигают выделяющийся водород. Обычно под конец происходит обугливание глицерина.
^ Реакция с гидроксидом меди . С увеличением числа гидроксильных групп в молекуле вещества возрастает подвижность атомов водорода, т.е. увеличиваются кислотные свойства. Поэтому атомы водорода могут замещаться не только на активные щелочные металлы. Так, например, многоатомные спирты взаимодействуют с гидроксидом меди (уравнение приведено в упрощенном виде):
В демонстрационной пробирке (цилиндре, химическом стакане) получают гидроксид меди, добавляя к 4-5 мл раствора медного купороса раствор щелочи до полного осаждения гидроксида. Для успеха опыта щелочь должна быть непременно в избытке, поэтому, ставя опыт, учитель должен соотнести концентрации имеющихся растворов.
Осадок взбалтывают и половину его переносят в другую пробирку. К одной порции добавляют глицерин, пока при взбалтывании осадок гидроксида не исчезнет и Fie образуется темно-синий раствор. Сравнивают окраску раствора с окраской осадка гидроксида в другой пробирке.
Реакция с гидроксидом меди считается качественной реакцией на многоатомные спирты.
ФЕНОЛ
В данном разделе наиболее существенными являются опыты, показывающие растворимость фенола в щелочи, дезинфицирующее действие его и характер взаимного влияния атомов в молекуле фенола.
Растворимость фенола в воде и щелочах. В пробирку с несколькими кристалликами фенола приливают 2-3 мл воды. Пробирку закрывают пробкой и встряхивают. Убеждаются, что фенол не полностью растворился в воде и образовал непрозрачную эмульсию. Дают эмульсии отстояться, жидкость расслаивается: внизу образуется раствор воды в феноле, вверху - раствор фенола в воде.
Содержимое пробирки снова взбалтывают и к эмульсии фено-
Ла прибавляют по каплям раствор щелочи. Раствор становится прозрачным, так как образующийся фенолят растворим в воде:
С 6 Н 5 ОН + NaOH С 6 Н 5 ОNa + Н 2 О
В этой реакции фенол проявляет кислотные свойства. Это подтверждается и тем, что при действии кислот (добавляют по каплям соляную кислоту) фенол снова выделяется из раствора:
C 6 H 5 ONa + HCI C 6 H 5 ONa + NaCl
^ Фенол - слабая кислота . Для приблизительного определения силы кислоты достаточно установить, какими кислотами она может вытесняться из солей. Фенол слабее угольной кислоты, поэтому при действии угольной кислоты на фенолят натрия образуется фенол:
С 6 Н 5 ОNa + (H 2 CO 3) С 6 Н 5 ОН + NaHCO 3
Раствор фенолята натрия получают, прибавляя раствор щелочи к эмульсии фенола (избегать избытка щелочи!). Далее в него пропускают углекислый газ из аппарата Киппа. Образуется муть вследствие выделения свободного фенола.
^ Реакция фенола с бромной водой . Опыты, на которых можно развить идею о взаимном влиянии атомов в молекулах, имеют большое воспитательное значение. Взаимное влияние атомов можно рассмотреть на примере фенола после ознакомления с его кислотными свойствами.
Большая в сравнении со спиртами подвижность гидроксильного атома водорода в молекуле фенола (реакция со щелочью) обусловлена влиянием на гидроксильную группу соединенного с ней бензольного кольца. Гидроксильная группа в свою очередь влияет на бензольное ядро, ослабляя в орто- и пара-положениях связи атомов водорода с атомами углерода, вследствие чего атомы водорода значительно легче, чем в бензоле, замещаются атомами брома. Бензол, как известно, не реагирует с бромной водой (реагирует с чистым бромом в присутствии железа), фенол же легко реагирует с бромной водой, сразу замещая на бром три атома водорода в своей молекуле.
В демонстрационную пробирку берут немного (на кончике ножа) фенола и добавляют воды столько, чтобы при взбалтывании получился раствор (а не эмульсия) фенола. Далее прибавляют насыщенную бромную воду. Сначала образуется белая муть, а затем осадок трибромфенола:

Трибромфенол обладает устойчивым неприятным запахом, поэтому надо остерегаться попадания его на руки и одежду.
^ Качественная реакция фенола. Характерной качественной реакцией на фенолы является взаимодействие с хлоридом железа(III). К разбавленному раствору (не эмульсии!) фенола добавляют несколько капель раствора хлорида железа FeCI 3 , Жидкость окрашивается в темно-фиолетовый цвет (белый экран!).
Дезинфицирующее действие фенола. Дезинфицирующее действие фенола основано на том, что он свертывает белок, чем прекращает жизнедеятельность бактерий.
Это действие наблюдают, прибавляя к небольшому количеству раствора куриного яйца в пробирке расплавленный фенол и взбалтывая смесь.
Следует указать учащимся, что этим же свойством фенола обусловливается появление белых пятен на коже рук при неосторожном обращении с ним.
^ Нитрование фенола . При нитровании фенола образуется тринитрофенол - пикриновая кислота:

К 3 мл концентрированной азотной кислоты в пробирке приливают 1 мл (не больше) воды и в разбавленную, таким образом кислоту вносят по каплям 0,5 мл расплавленного фенола. Полученную смесь взбалтывают и нагревают до кипения. При последующем охлаждении образуются красивые желтые кристаллы пикриновой кислоты.
^ Получение фенола из салициловой кислоты . Способы получения фенола не рассматриваются в школьном курсе химии. На внеклассных занятиях (лучше после изучения кислот) можно поставить опыт получения фенола из салициловой кислоты. Существует большая аналогия между получением метана, бензола и фенола при
взаимодействии соответствующих кислот или их солей со щелочью. Везде происходит образование карбоната и соответствующего углеводорода или его производного:
CH 3 COONa + NaOH CH 4 + Na 2 CO 3
C 6 H 5 COONa + NaOH C 6 H 6 + Na 2 CO 3

Для получения фенола можно воспользоваться салицилатом натрия или непосредственно салициловой кислотой. Эти вещества могут быть приобретены в аптеке.
В пробирку с отводной трубкой помещают смесь примерно одинаковых объемов салициловой кислоты, гидроксида натрия и оксида кальция. Смесь нагревают, опустив отводную трубку в известковую воду. Убеждаются в выделении углекислого газа. Затем отводную трубку опускают в сухую пробирку и отгоняют столько фенола, сколько позволяет исходное количество салициловой кислоты. Убеждаются в получении фенола по запаху и по реакции с раствором хлорида железа. Применять холодильник приэтом, разумеется, нет необходимости.
